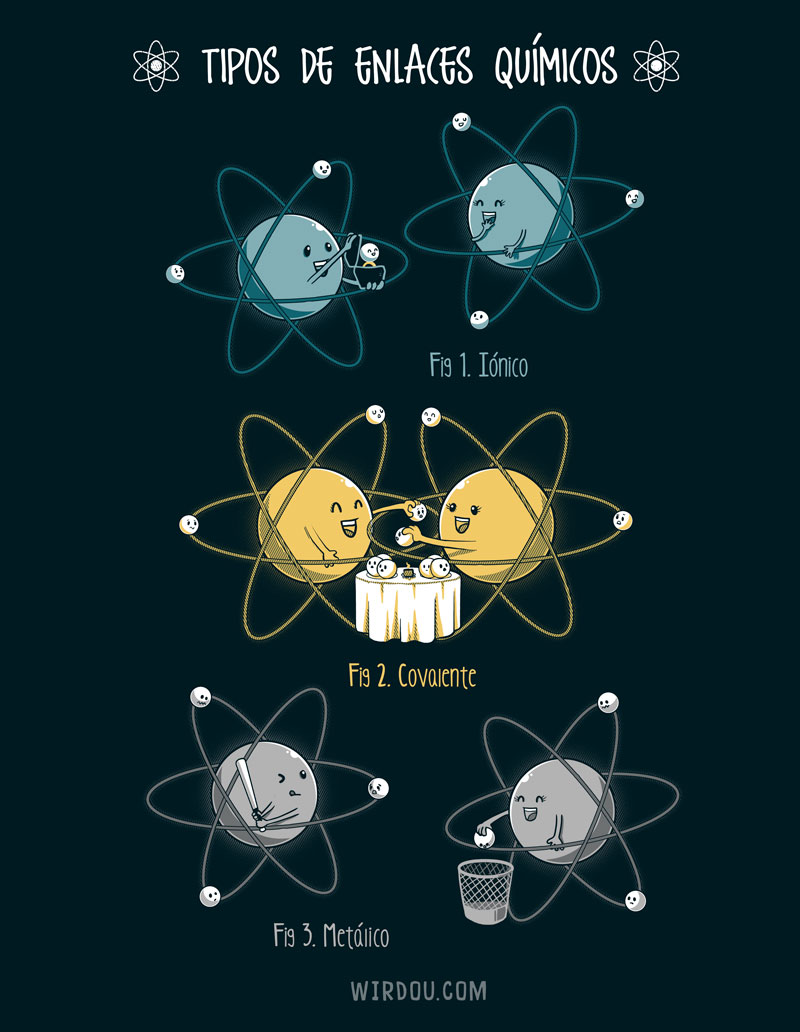
Tots els àtoms (tret dels gasos nobles) s’uneixen entre ells mitjançant enllaços químics. Hi ha tres tipus d’enllaços químics:
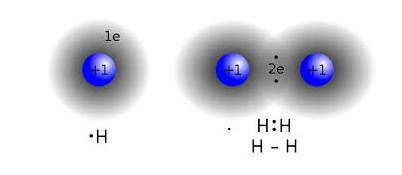
- Enllaç covalent. La molècula d’hidrogen està formada per dos àtoms, cadascun d’ells té un nucli amb càrrega positiva i un electró, que orbita arran el nucli, de càrrega negativa. Els dos electrons s’atrauen i s’ajunten, formant així un enllaç covalent que forma la molècula d’hidrogen. Aquest és un enllaç molt fort i per tant molt difícil de separar. Es forma entre els elements no metàl·lics.
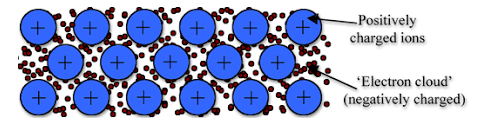
- Enllaç metàl·lic. Com diu el nom, és característic dels metalls. L’estructura d’un metall consisteix en àtoms que han perdut més d’un electró; tots els electrons volten entre els ions positius, formant un núvol d’electrons. Com que els ions positius es repel·leixen, s’entén que els ions negatius fan de “ciment”. És un enllaç fort, i la seva fortalesa augmenta amb el nombre d’electrons voltant pel cristall. El fet que els ions negatius voltin pel cristall explica perquè els metalls són conductors d’electricitat i calor.
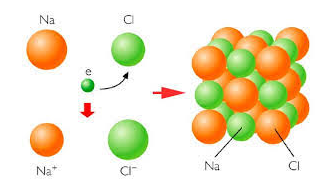
- Enllaç iònic. És la unió de, per exemple, ions de clorur i ions de sodi. Com que estan disposats alternadament, els ions positius estan envoltats de ions negatius i a l’inrevés; aquests s’atrauen amb forces electroestàtiques, i això forma un enllaç iònic. És un enllaç molt fort amb un punt d’ebullició molt alt; en estat sòlid no condueix electricitat, però sí que ho fa en estat líquid o en dissolució.